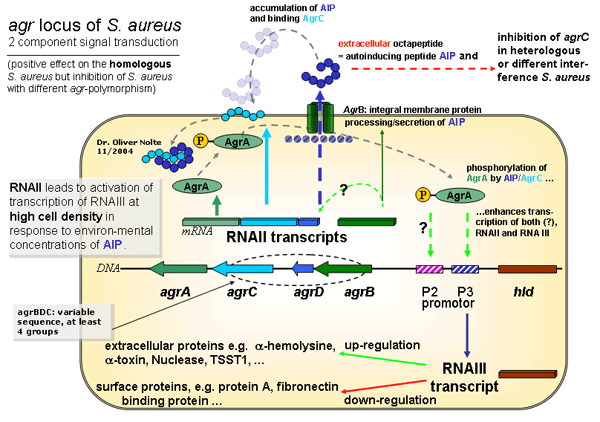
Genetik des agr-Genlokus von Staphylococcus aureus(Genetics of agr of Staphylococcus aureus) Autoregulation der Expression von VirulenzfaktorenDer agr-Locus (accessory gene regulator) codiert für fünf Genprodukte, die über zwei Transkripte (mRNAII und mRNAIII) in ihrer Expression gesteuert werden. RNAII ist eine RNA mit Sequenzinformationen für vier Gene, agrB, agrD, agrC und agrA. Das agrB Gen codiert für ein Membranständiges Protein, welches neben seiner Funktion als Pore offenbar auch an der Reifung (Prozessierung) des agrD Genprodukts beteiligt ist. Beim Genprodukt von agrD handelt es sich um ein Octapeptid (acht Aminosäuren) welches sich in der extrazellulären Matrix sammelt. Vor dem Austritt aus der Bakterienzelle (prämatures, unreifes Peptid) durchläuft es eine noch unbekannte Prozessierung. Dem reifen Octapeptid (dunkelblau) kommt eine autoinduzierende Funktion zu, daher wird die Bezeichnung AIP (autoinducing peptide) für dieses Peptid verwendet. AIP führt erst ab einer bestimmten Konzentration zu einer biologischen Wirkung. In Kultur müssen die Bakterien offenbar erst die stationäre Phase der Wachstumskurve erreichen, bevor die Konzentration von AIP einen kritischen Schwellenwert erreicht. Nach Erreichen dieser Schwellenkonzentration in der extrazellulären Matrix führt die Bindung an das Genprodukt von agrC, ein Membranständiges Protein zur Internalisierung des AgrC/AIP Komplex. Dieser Komplex hat Kinase-Funktion und führt intrazellulär zur Phosphorylierung des agrA Genprodukts. Das phosporylierte AgrA (AgrA-P) fungiert als Transkriptionsenhancer (Verstärker der Transkription).
(Abbildung unter Berücksichtigung publizierter Fachartikel bis November 2004) Das bedeutet, dass nach Bindung von AgrA-P an den P2/P3 Promotor die Translation von RNAIII ansteigt. RNAIII ist ein regulatorisches RNA-Molekül. Die biologische Wirkung dieses Moleküls besteht in einer Negativregulation von Oberflächenassoziierten Proteinen wie Protein A, Fibronektinbindeprotein und anderen und zur Positivregulation extrazellulärer Proteine wie Hämolysin a, a-Toxin, der Nuclease oder TSST-1.
Interspezifische KonkurrenzEin großer Teil der menschlichen Population ist mit S. aureus besiedelt. In der Mehrzahl der Fälle bleibt diese Besiedlung ohne direkt Folgen, der S. aureus fungiert als opportunistischer Besiedler. Bei gesunden Keimträgern beobachtet man, dass oftmals nur S. aureus einer agr Sequenzgruppenzugehörigkeit in den Nasenvorhöfen gefunden werden. Diese eventuelle Exklusion von S. aureus unterschiedlicher agr Sequenzgruppenzugehörigkeit geht möglicherweise auf einen Polymorphismus am agr-Genlocus zurück. Ein Teil der für agrBDC codierenden DNA ist hypervariabel. Hierdurch entsteht eine Spezifität zwischen dem AIP und dem Genprodukt von agrC. Damit wird es möglich, dass bei S. aureus, die den gleichen Sequenztyp in agrBDC aufweisen, das System autokatalytisch wirkt. Die Sequenzunterschiede (Polymorphismus) führen aber auch dazu, dass AIP eines S. aureus mit einer bestimmten agr Sequenzgruppenzugehörigkeit einen negativ regulatorischen Effekt auf das agr-System eines S. aureus mit einer anderen agr Sequenzgruppenzugehörigkeit ausübt. Dabei wird der konkurrierende S. aureus Stamm nicht am Wachstum gehindert oder gar abgetötet. Vielmehr wird nur die Expression seiner Virulenzfaktoren (Exoenzyme, Gewebsschädigende Enzyme, etc.) verhindert, wodurch der inhibierte S. aureus Stamm einen Standortnachteil erleidet, der in der Folge möglicherweise zu seinem Verschwinden führt. Die Abbildung und der Text wurden erstellt unter zu Hilfenahme der Informationen aus folgenden Publikationen/Figure and text were created using information published in the following original research articles: Gilot P, Lina G, Cochard T, Poutrel B (2002): Analysis of the genetic variability of genes encoding the RNA III activating components Agr and TRAP in a population of Staphylococcus aureus strains isolated from cows with mastitis. J. Clin Microbiol. 40(11):4060-4067 Goerke C, Kümmel M, Dietz K, Wolz C (2003): Evaluation of intraspecies interference due to agr polymorphism in Staphylococcus aureus during infection and colonization. J. Infect. Dis. 188:250-256 Jarraud S, Lyon GJ, Figueiredo Ams, Lina G, Vandenesch F, Etienne J, Muir TW, Novick RP (2000): Exfoliative-producing strains define a fourth agr specificity group in Staphylococcus aureus. J. Bact. 182(22):6517-6522 Ji G, Beavis R, Novick RP (1997): Bacterial interference caused by autoinducing peptide variants. Science 276:2027-2030 Papakyriacou H, Vaz D, Simor A, Louie M, Mcgavin MJ (2000): Molecular analysis of the accessory gene regulator (agr) locus and balance of virulence factor expression in epidemic methicillin-resistant Staphylococcus aureus. J. Infect. Dis. 181:990-1000 Shopsin B, Mathema B, Alcabes P, Said-Salim B, Lina G, Matsuka A, Martinez J, Kreiswirth BN (2003): Prevalence of agr specificity groups among Staphylococcus aureus strains colonizing children and their guardians. J. Clin. Microbiol. 41(1):456-459 zuletzt geprüft/geändert: |
|||